Termologia
Escolha o assunto e comece seus estudos!
“Em algum lugar, alguma coisa incrível está esperando para ser descoberta.”
Carl Sagan
Termologia
LISTA 49 – GASES IDEAIS
01. (FUVEST) Um laboratório químico descartou um frasco de éter, sem perceber que, em seu interior, havia ainda um resíduo de 7,4 g de éter, parte no estado líquido, parte no estado gasoso. Esse frasco, de 0,8 L de volume, fechado hermeticamente, foi deixado sob o sol e, após um certo tempo, atingiu a temperatura de equilíbrio T = 37º C, valor acima da temperatura de ebulição do éter. Se todo o éter no estado líquido tivesse evaporado, a pressão dentro do frasco seria
a) 0,37 atm.
b) 1,0 atm.
c) 2,5 atm.
d) 3,1 atm.
e) 5,9 atm.
NOTE E ADOTE
No interior do frasco descartado havia apenas
éter.
Massa molar do éter = 74 g
K = oC + 273
R (constante universal dos gases) = 0,08 atm.L / (mol.K)
02. (UNESP) Uma panela de pressão com capacidade de 4 litros contém, a uma temperatura de 27ºC, 3 litros de água líquida à pressão de 1 atm. Em seguida, ela é aquecida até que a temperatura do vapor seja de 127ºC, o volume de água líquida caia para 2,8 litros e o número de moléculas do vapor dobre. A panela começa a deixar escapar vapor por uma válvula, que entra em ação após a pressão interna do gás atingir um certo valor máximo. Considerando o vapor como um gás ideal, determine o valor dessa pressão máxima.
03. (ENEM) Uma pessoa abre sua geladeira, verifica o que há dentro e depois fecha a porta dessa geladeira. Em seguida, ela tenta abrir a geladeira novamente, mas só consegue fazer isso depois de exercer uma força mais intensa do que a habitual. A dificuldade extra para reabrir a geladeira ocorre porque o (a)
a) volume de ar dentro da geladeira diminuiu.
b) motor da geladeira está funcionando com potência máxima.
c) força exercida pelo ímã fixado na porta da geladeira aumenta.
d) pressão no interior da geladeira está abaixo da pressão externa.
e) temperatura no interior da geladeira é inferior ao valor existente antes de ela ser aberta.
04. (FUVEST) Uma garrafa tem um cilindro afixado em sua boca, no qual um êmbolo pode se movimentar sem atrito, mantendo constante a massa de ar dentro da garrafa, como ilustra a figura. Inicialmente, o sistema está em equilíbrio à temperatura de 27ºC. O volume de ar na garrafa é igual a 600 cm3 e o êmbolo tem uma área transversal igual a 3 cm2. Na condição de equilíbrio, com a pressão atmosférica constante, para cada 1ºC de aumento da temperatura do sistema, o êmbolo subirá aproximadamente
a) 0,7 cm
b) 1,4 cm
c) 2,1 cm
d) 3,0 cm
e) 6,0 cm
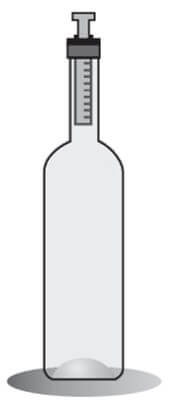
Note e adote: 0ºC = 273 K Considere o ar da garrafa como um gás ideal.
05. (FUVEST) Em um “freezer”, muitas vezes, é difícil repetir a abertura da porta, pouco tempo após ter sido fechado, devido à diminuição da pressão interna. Essa diminuição ocorre porque o ar que entra, à temperatura ambiente, é rapidamente resfriado até a temperatura de operação, em torno de −18°C. Considerando um “freezer” doméstico, de 280 L, bem vedado, em um ambiente a 27°C e pressão atmosférica P0, a pressão interna poderia atingir o valor mínimo de
a) 35 % de P0
b) 50 % de P0
c) 67 % de P0
d) 85 % de P0
e) 95 % de P0
Considere que todo o ar no interior do “freezer”, no instante em que a porta é fechada, está à temperatura do ambiente.
06. (FAMERP) A oxigenoterapia hiperbárica é uma modalidade terapêutica na qual o paciente respira oxigênio puro (100%), enquanto é submetido a uma pressão cerca de 2 a 3 vezes a pressão atmosférica ao nível do mar, no interior de uma câmara hiperbárica. Essa terapia provoca um aumento espetacular na quantidade de oxigênio transportado pelo sangue, na ordem de 20 vezes o volume que circula em indivíduos que estão respirando ar ao nível do mar, o que produzirá no paciente uma série de efeitos de interesse terapêutico. A câmara hiperbárica consiste em um equipamento médico fechado, resistente à pressão, geralmente de formato cilíndrico, construído de aço ou acrílico e que pode ser pressurizado com ar comprimido ou oxigênio puro.
(https://sbmh.com.br. Adaptado.)
Considere que o ar se comporta como um gás ideal, que o ar no interior da câmara hiperbárica esteja à pressão atmosférica, que o volume da câmara hiperbárica não se altere e que a temperatura no seu interior não varie. O número de mols de ar que devem ser injetados na câmara, em relação à quantidade existente inicialmente (n0), para produzir no interior da câmara uma pressão igual a 2,8 vezes a pressão atmosférica é
(A) 1,8n0.
(B) 3,8n0.
(C) 1,4n0.
(D) 0,9n0.
(E) 2,4n0.
07. (FMABC) Muitas pessoas têm dificuldades para respirar ao viajarem para cidades localizadas em altitudes elevadas, devido à menor disponibilidade de oxigênio no ar nessas regiões. Considere que, ao nível do mar, a pressão atmosférica é 1,0 × 105 Pa e a temperatura é 300 K, e que a 3500 m de altitude a pressão se reduz a 6,3 × 104 Pa e a temperatura a 270 K. Considerando-se o ar como um gás ideal, a razão entre a quantidade de oxigênio por metro cúbico de ar em uma cidade localizada à altitude de 3500 metros e a quantidade de oxigênio por metro cúbico de ar em um local ao nível do mar é
a) 0,65.
b) 0,70.
c) 0,60.
d) 0,75.
e) 0,80.
08. (UNESP) Para simular o sistema respiratório humano, um aparato com duas bexigas representando os pulmões, uma membrana elástica representando o músculo diafragma e um tubo flexível em forma de “Y”, representando a traqueia e os brônquios, foi montado dentro de um recipiente plástico que representava a caixa torácica. Na figura 1, as bexigas estão vazias. Deslocando-se a membrana elástica para baixo, as bexigas se enchem, conforme a figura 2.
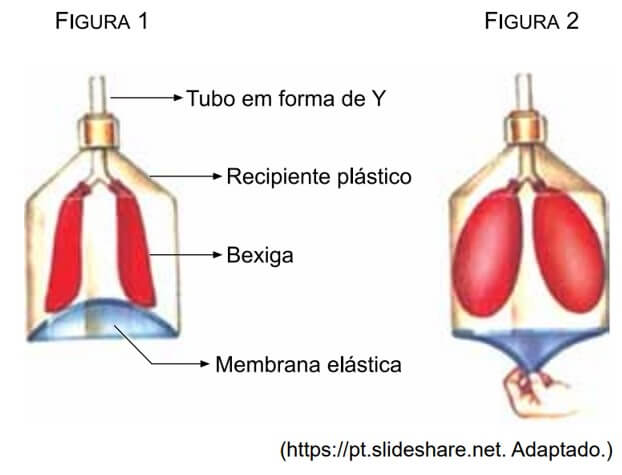
Em uma analogia entre esse aparato e o sistema respiratório humano, o deslocamento da membrana elástica para baixo corresponde
(A) à contração do diafragma, que aumenta o volume da caixa torácica, fazendo com que a pressão interna dos pulmões fique maior do que a pressão ambiente.
(B) à contração do diafragma, que diminui o volume da caixa torácica, fazendo com que a pressão interna dos pulmões fique menor do que a pressão ambiente.
(C) à contração do diafragma, que aumenta o volume da caixa torácica, fazendo com que a pressão interna dos pulmões fique menor do que a pressão ambiente.
(D) ao relaxamento do diafragma, que aumenta o volume da caixa torácica, fazendo com que a pressão interna dos pulmões fique maior do que a pressão ambiente.
(E) ao relaxamento do diafragma, que aumenta o volume da caixa torácica, fazendo com que a pressão interna dos pulmões fique menor do que a pressão ambiente.
09. (UNESP 2023) Para se calibrar o pneu do carro num posto de serviços, a recomendação é colocar cerca 30 PSI, sigla em inglês para a unidade de pressão “libra-força por polegada quadrada”. Para o pneu de um avião, que é preenchido com nitrogênio puro em vez de ar, a regulagem recomendada é cerca de 200 PSI à temperatura ambiente de 300 K.

No entanto, no momento do pouso, essa pressão interna pode aumentar significativamente, como consequência do calor gerado pelo impacto e atrito com o solo e pela ação dos freios, com a temperatura podendo atingir 1200 K.
(www.uol.com.br. Adaptado.)
Supondo que o volume do pneu não se altere, a pressão interna de nitrogênio no pneu durante o pouso pode atingir o valor de
(A) 1000 PSI.
(B) 300 PSI.
(C) 600 PSI.
(D) 500 PSI.
(E) 800 PSI.
10. (UNICAMP 2023) O balonismo, um esporte aeronáutico com adeptos em todo o mundo, oferece um belo espetáculo para os observadores no solo. Um maçarico é usado para aquecer o ar no interior do balão, o que faz variar a densidade do ar, permitindo o controle do movimento de subida e descida do balão. Um balão tem um volume V = 1,6 × 103 m3 de ar quente no seu interior na temperatura T = 400 K e na pressão atmosférica p0 = 1,0 atm = 1,0 × 105 Pa. Sabendo-se que o ar quente se comporta como um gás ideal e que a constante universal dos gases é R ≅ 8 J/mol.K, quantos mols de ar n há no interior do balão?
a) 5,0 × 10−1 mol.
b) 4,0 × 100 mol.
c) 5,0 × 104 mol.
d) 4,0 × 105 mol.
Respostas
1- D
2- p2 @ 2,2 atm
3- D
4- A
5- D
6- A
7- B
8- C
9- E
10- C
